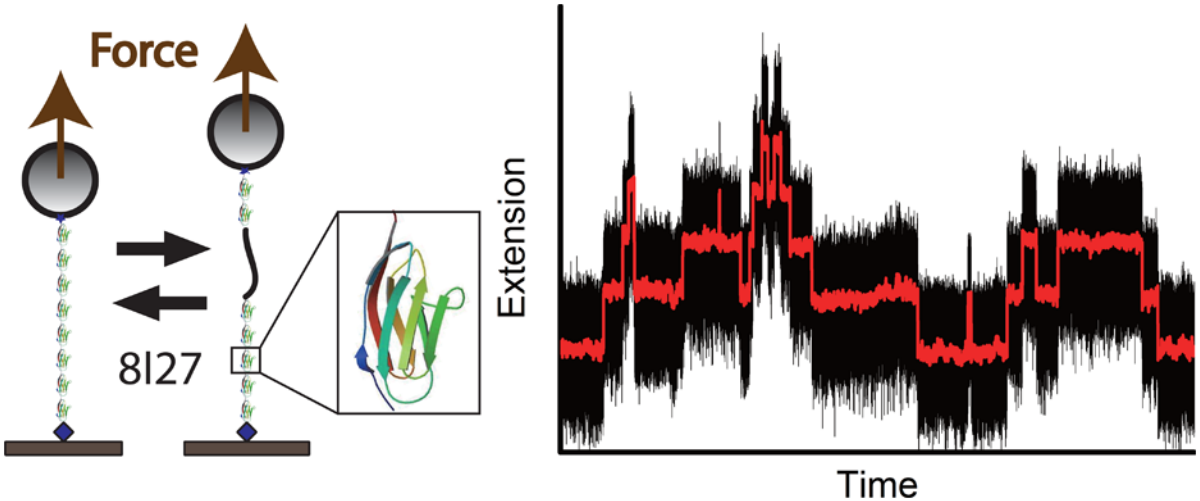
结构决定功能,仅仅知道DNA基因组序列并不能使我们充分了解蛋白质的功能,更无法知道它是如何工作的。蛋白质可凭借相互作用在细胞环境(特定的酸碱度、温度等)下自己组装自己,这种自我组装的过程被称为蛋白质折叠。蛋白质折叠问题被列为“21世纪的生物物理学”的重要课题,它是分子生物学中心法则尚未解决的一个重大生物学问题。研究蛋白质折叠,尤其是折叠早期过程,即新生肽段的折叠过程,是全面最终阐明蛋白质动力学过程的一个根本问题。其中,蛋白质受力后发生折叠和非折叠转变的动力学问题,是整体研究的重中之重,也是先决条件。然而,由于在复杂的蛋白质功能区中,折叠和非折叠的转变速率非常缓慢,这使得研究其平衡受力结构的转变成为一件非常困难的事情。
最近,这一难题在厦大生物仿生与软物质研究院陈虎教授团队的努力下,取得了重大突破。该团队通过使用超稳定的磁镊子,在Journar of the American Society杂志上发表了题为“Dynamics of Equilibrium Folding and Unfolding Transitions of TitinImmunoglobulin Domain under Constant Forces”的研究论文,报道了典型的骨骼纤维中的肌联蛋白——I27免疫球蛋白,其功能区的第一个平衡单分子在力的作用下发生变化的相关研究。研究者发现,单个I27分子是一个展开/折叠互相独立的串联重复序列(基因序列中的一种结构,首尾相连多次重复),且获得了非折叠的与折叠的I27在受到力的作用时的自由能差值,测定出在折叠和非折叠状态下有相等概率的临界力(约5.4 pN),得到了以将蛋白质从折叠状态延展开来所需的自由能为基准的、折叠/非折叠转变下的受力自由能分布图谱。此外,研究结果还表明,在肌肉长时间处于伸展状态时,提供较低的作用力,就可以让骨骼纤维中的肌联蛋白免疫球蛋白的功能区结构发生明显改变。
该研究结果对于研究肌肉的弹性也有着重要的生理意义。肌肉蛋白质里的超大肌联蛋白包含有超过300种免疫球蛋白和纤维连接蛋白功能区。这种蛋白质作为一个“分子弹簧”,可使肌肉具有弹性,并帮助固定肌球蛋白在肌原纤维节中的位置,在肌肉收缩中起着重要作用。在肌肉拉伸时,肌联蛋白之所以起作用,也依赖其免疫球蛋白功能区中的蛋白质序列的折叠和展开。根据该团队的实验所得的极小临界力(约5.4 pN)表明,在肌肉长时间处于伸展活动状态(如瑜伽)时,施加低作用力,即可使肌联蛋白的免疫球蛋白的构象发生显著改变。此外,将埋藏在免疫球蛋白功能区的作用点人工暴露出来,研究发现其可能会后续与其他蛋白质发生相互作用,这对研究肌肉的弹性机理也有着重要作用。
《JACS(Journar of the American Society)》杂志,中文名为《美国化学会志》,是材料与化学类杂志的龙头(谷歌学术将所有学科分为八大领域,JACS位列材料与化学大领域第一),可以说是每个材料与化学人梦寐以求的能发一篇论文的地方。
论文链接: http://pubs.acs.org/doi/abs/10.1021/ja5119368
The New Translation of Proteins’ Functions —— Dynamics of Equilibrium Folding and Unfolding Transitions of Titin under Constant Forces
Hu Chen,†,‡,⊥ Guohua Yuan,†,‡,⊥ Ricksen S. Winardhi,‡ Mingxi Yao,‡ Ionel Popa,¶ Julio M. Fernandez,¶ and Jie Yan*,‡,§,∥
Journar of the American Society,2015, 137, 3540−3546
DOI: 10.1021/ja5119368
The mechanical stability of force-bearing proteins is crucial for their functions in tissue development and maintenance. However, slow transition rates of complex protein domains have made it challenging to investigate their equilibrium force-dependent structural transitions. Using ultra stable magnetic tweezers, Prof Hu Chen and coauthors report the first equilibrium single-molecule force manipulation study of the classic titin I27 immunoglobulin domain, and found that individual I27 in a tandem repeat unfold/fold independently. Researchers obtained the force-dependent free energy difference between unfolded and folded I27, determined the critical force at which unfolding and folding have equal probability, and determined the force-dependent free energy landscape of unfolding/folding transitions based on measurement of the free energy cost of unfolding. In addition, the results suggest that the conformations of titin immunoglobulin domains can be significantly altered during low force, long duration muscle stretching. The results of the force-dependent folding and unfolding transitions of I27 have important physiological implications on muscle elasticity. This work was published inJ. Am. Chem. Soc.(2015, DOI: 10.1021/ja5119368)
刘倩(撰写)


 关于我们
关于我们
 咨询反馈
咨询反馈
 厦门大学物理科学与技术学院
厦门大学物理科学与技术学院